多肽和蛋白质类药物指用于预防、治疗和诊断的多肽和蛋白质类物质生物药物,目前已广泛存在并被应用于我们的日常生活中。而该类药物的传统给药方式为静脉注射,存在患者依从性差的致命缺点。口服和透皮给药系统等非侵入性和高依从性给药策略为这一问题带来了良好的解决方案,却由于药物难以克服胃肠道和皮肤的障碍(渗透性差)而药效不佳。因此,基于化学策略、合成纳米颗粒、医用微器件等新材料和新技术的快速发展在克服这些生理障碍方面提供了许多有前景的路径[1]。
口服给药作为众多患者首选的治疗途径,虽然安全性高,但却需要克服胃肠道中的极端pH值、蛋白酶、阻碍大分子的渗Kaiyun中国网页登录入口透的黏液层、粘液蛋白水解酶等影响药物有效成分发挥作用的重重阻碍。而随着科学技术的发展,提高蛋白质口服生物利用度的策略也层出不穷。
化学修饰作为最常用的手段之一,是指通过引入额外的基团对药物进行结构修饰(酯化等),该方式可以提高蛋白质的酶稳定性,以及膜的通透性(聚乙二醇化),增强蛋白质的吸收,从而提高生物利用度[2-3]。 另一种化学方法是修饰蛋白质和多肽的链主干,包括环化策略和氨基酸取代。前者相较于线性多肽能够掩盖易降解多肽的C端和N端,以提高胃肠道酶的稳定性;后者也在和胰岛素相关的研究中使蛋白质水解稳定性提高了数倍。
渗透增强剂可以迅速地和可逆地打开膜通道或紧密连接体,用于跨膜或细胞间运输 [4]。迄今为止,包括离子液体、细胞穿透肽(CPPs)、脂肪酸、乙二胺四乙酸(EDTA)等在内的许多渗透增强剂在临床前研究中被报道可改善蛋白质的口服吸收。且目前在临床试验中的大多数口服蛋白质传递平台都是基于通常被认为是安全(GRAS)无毒的渗透增强剂,没有毒性问题。
由于纳米给药系统的构筑具备避免药物降解、靶向给药、控制药物释放速率和增强药物肠道通透性等优势,其已成为口服蛋白质给药的有前途的平台[5]。
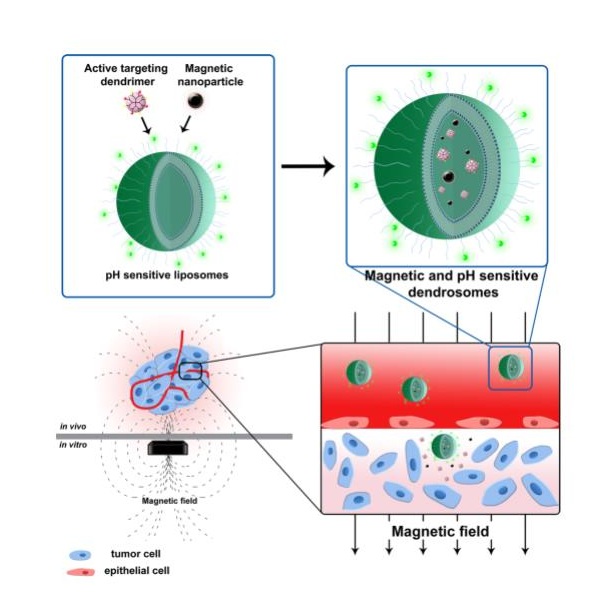
脂基NPs因其能够携带疏水和亲水化合物、控制药物释放和高生物相容性而在药物传递中受到极大关注。利用苯硼酸的糖响应性和包载胰岛素的脂质体构筑了口服胰岛素给药系统,最终得到了有效调节1型糖尿病小鼠餐后血糖波动的效果[6]。
图2. 用于口服胰岛素输送的葡萄糖响应性及Fc受体靶向的脂质体示意图[6]。
表面活性剂具备两亲性结构,能够在临界胶束浓度下形成具有疏水核心和亲水外表面的胶束。以此为载体可以增强蛋白质的酶稳定性和肠道吸收[7]。
天然聚合物,如壳聚糖、海藻酸钠、透明质酸等各种多糖已被广泛用于蛋白质的口服给药系统构筑中。而与天然聚合物相比,合成聚合物具有更可控的分子量和降解性能。基于功能性配体修饰的聚合NPs在肠道吸收和靶向递送方面提供了更多的优势。
虽然在口服给药方面有机材料仍然是药物的主要载体,但无机材料也因其具备优越的稳定性(可以在高酸性和酶促环境中保护其有效载荷)而不失为一种有吸引力的替代品。各种无机NPs已被探索用于口服蛋白质药物的输送,如二氧化硅、金、硒等。其中,二氧化硅NPs由于其独特的多孔结构,具有明显的高载药量和持续释放药物的优势。
金属-有机框架(MOFs)是由金属离子和有机配体通过配位化学自组装的介孔杂化材料。具有多孔结构的MOFs可以实现高载药量,并保护蛋白质在胃环境中不被降解。如Tian等人构筑了具有耐酸性能的经转铁蛋白的修饰的MOFs材料,可克服口服胰岛素的肠上皮屏障,并有效提高大鼠口服胰岛素的生物利用度[8]。除MOFs外,由有机元素组成并通过共价键连接的共价有机框架(COFs)也已应用于药物输送。
图3. 具有耐酸性能的经转铁蛋白的修饰的MOFs材料的构筑及细胞转运途径示意图[8].
与合成材料相比,来自生物系统的仿生载体在稳定性、自然靶向性、生物相容性以及克服体内生理障碍的能力方面具有独特的优势。
基因生物工程促使人们努力开发基于微生物的可重复编程蛋白质疗法,基于工程菌株或细胞的口服蛋白质输送具有巨大潜力。
水凝胶具有亲水的3D网络支架结构,能够吸收大量的水并在生理环境中膨胀。所形成的具有合适机械强度的高分子网络既能使蛋白质药物持续释放,又能防止其被蛋白酶降解。其中,生物刺激响应型水凝胶能够发生结构改变以响应生理环境信号(如pH值、温度、氧化还原和离子变化)导致水凝胶系统膨胀并随后释放药物[9]。值得关注的是,酶降解水凝胶和pH响应水凝胶在口服蛋白质输送方面有很大的前景。
例如,Hu等人构筑的耐酸性pH响应DNA水凝胶能够在生物特定部位的pH条件下选择性释放胰岛素,从而显著增强了胰岛素的口服吸收[10]。
微针器件具有微创性,并通常被应用用于经皮给药过程。基于微针的药物系统构筑多种多样,例如Langer课题组设计的一种具有自定位功能的用于口服递送大分子药物的毫米级给药系统(SOMA)能在胃内释放有效载荷[11];同时该课题组近期报道的可用于多种蛋白质递送的液体注射SOMA(liquid-injecting SOMA,L-SOMA)为需要快速作用的药物提供了一种无创给药途径[12]。
除口服给药外,经皮给药具有无创性、便利性和患者依从性,为注射途径提供了一种有前途的替代方案。值得注意的是,皮肤作为阻止外来入侵者的天然屏障得同时,也是药物渗透的主要障碍,这一屏障显著阻碍了蛋白透皮传递的潜力。如何克服这些障碍成为了经皮给药过程的一大难题。
通常来说,醇、表面活性剂、脂肪酸和酯类等化学增强剂是通过增强药物的溶解度和引起膜脂质的破坏而起作用的,因此化学增强剂所面临的一大挑战是其对深层皮肤存在难以避免的毒性作用。
离子电泳包括电迁移或电渗透,利用低电压将带电分子推入皮肤。与之不同的是,电穿孔通过短时间内施加高电压实现皮肤脂质结构的可逆破坏,其中高压脉冲在细胞膜上打开一个孔,使DNA或蛋白质进入细胞。即,离子导入主要作用于药物,而电穿孔作用于皮肤。
作为常用的物理方法用于药物递送过程,除了电,热可通过在角质层产生许多微米级的穿孔来促进药物的皮肤渗透性,即热消融。这是一种选择性地穿透角质层并避免损伤深层组织的物理技术。
机械力为基础的药物传递系统也有助于透皮蛋白传递,如超声波导入药物给药和喷气注射器(一种可代替皮下针的无针透皮设备,可实现对更大面积皮肤组织的无创给药。)
除了化学和物理策略的使用外,生物医学器件已成为一种新兴的、有前途的透皮蛋白质传递平台。值得关注的是,微针贴片可以无痛破坏角质层从而形成药物转运的微通道,该微通道在贴片移除后可迅速恢复。
通过生物响应性(血糖水平、pH等)材料的构建用于药物递送系统,能够在减少药物毒副作用的同时达到治疗性药物时空可控释放的目的。例如通过引入葡萄糖氧化酶GOx构筑基于酶促反应和血糖响应的药物(胰岛素)递送系统[13-15];或通过苯硼酸(PBA)的电荷响应功能构筑葡萄糖响应性胰岛素、胰高血糖素的药物释放系统[16-17]等。
大自然天然的设计构造通常会给予科研工作者许多启发,因此仿生和仿生材料的构筑通常从自然界汲取灵感,这推动了具有多功能结构和性能的纳米材料的设计与发展。例如科研工作者从某种虫子、用于输送毒液的毒蛇牙齿、鲨鱼牙齿的特殊结构中汲取灵感设计出能够定向输送药物的微针贴片[18-20]。
独特的胃肠道环境给口服蛋白质的开发带来了巨大的挑战。尽管各种给药方式已被开发用于解决这一问题,但生物利用度仍旧不高,且缺乏在大型动物模型中的体内检验。因此也难以预测其在人类身上的治疗效果。近年来,微针给药系统已被应用于各种生物制剂的透皮给药,其患者依从性高的但同时低皮肤损伤高机械强度、高载药量的微针贴片的开发依然值得期待。
Copyright © 2025 开云智能科技中国股份有限公司 版权所有 备案号:晋ICP备2023022755号-1